Материалы по истории астрономии
| На правах рекламы: • Ценообразование в гостинице . Для каждой услуги создается один или несколько тарифов. Тариф – это условное наименование ценовой позиции в прайс-листе. Сама же стоимость услуги определяется ставкой тарифа, причем эта ставка может меняться со временем. |
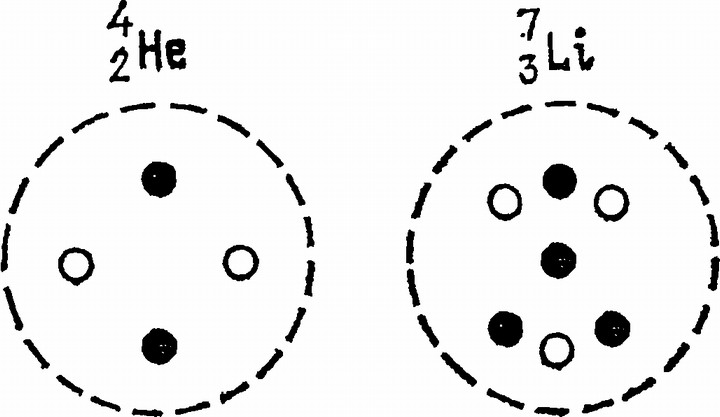
Ядра и ядерные реакцииНаш знаменитый соотечественник Д.И. Менделеев еще в 1869 г. распределил все известные в его время химические элементы в таблице, всему миру известной теперь под названием таблицы Менделеева. Элементы расположены в ней в порядке масс их атомов, причем места элементов в таблице связаны с их химическими свойствами. Все открытые впоследствии химические элементы улеглись в клетки таблицы Менделеева, оставшиеся пустыми и ныне достигли числа 1071. Порядковый номер элемента в этой таблице, начиная с 1 для водорода и кончая числом 107, называется атомным номером и обозначается Z. Впоследствии физики открыли, что существуют атомы, имеющие несколько различные относительные атомные массы, но совершенно одинаковые химические свойства, и назвали их изотопами. Многие химические элементы представляют смесь таких изотопов, причем процент того и другого изотопа в их природной смеси оказывается почти всегда постоянным. Относительная атомная масса каждого изотопа, обозначаемая А, по сравнению с массой атома водорода выражается почти точно целым числом. Неодинаковая доля участия изотопов в их смеси, известной химикам просто под названием того или другого элемента, и обусловила то, что в таблице Менделеева встречаются относительные атомные массы, не выражаемые целыми числами. При этих исследованиях были открыты, в частности, изотоп водорода с атомной массой 2 (тяжелый водород, или дейтерий) и изотоп гелия с атомной массой 3, тогда как до этого считалось, что относительные атомные массы этих элементов близки к 1 и к 4. «Тяжелого водорода» и «легкого гелия» встречается в природе очень мало, и поэтому масса «обычных атомов» (т. е. средняя относительная атомная масса) этих элементов очень близка к относительной атомной массе их основных изотопов, равной соответственно 1 и 4. Все это изменило прежние представления о том, что различие в относительной атомной массе является главной причиной различия в химических свойствах элементов. В помещенной здесь табличке приведены атомные номера Z и относительные атомные массы А изотопов наиболее легких химических элементов, а также процентное участие каждого в их смеси, известной на Земле. Мы видим, например, что у бериллия нет изотопов, а у кислорода их целых три. Представление об атомах как о маленьких неделимых шариках пришлось заменить более сложным. Нормальный атом с атомным номером Z состоит из крохотного ядра (диаметром порядка 10-13 см), окруженного свитой из Z электронов. Электрон несет наименьший возможный заряд отрицательного электричества. Заряд Z электронов уравновешивает такой же по величине, но положительный заряд ядра. Если такой нейтральный атом потеряет один-два электрона, он приобретает единичный или двойной положительный электрический заряд, становясь положительным ионом, а если ему удается завлечь в свою свиту лишний электрон, то, получив этим единичный отрицательный заряд, он становится отрицательным ионом. Так, нейтральный атом водорода имеет один электрон, атом гелия — 2 электрона и т. д. Масса электронов составляет 0,000544 массы атома (практически — массы ядра) водорода, и 1836 штучек их надо было бы насыпать на чашку весов, чтобы уравновесить одно водородное ядро. Потеря электронов мало влияет на массу атомов. Изотопы легких элементов
Химик, имея дело, скажем, с водородом или азотом, обозначает их H и N. Физик различает их изотопы, отличающиеся по массе, и обозначает их 1Н и 2Н, 14N и 15N, ставя слева вверху химического символа относительную атомную массу А. Имея при этом в виду ядра атомов, он ставит еще внизу слева их атомный номер, например,11H,21N,147N и 157N электроны же обозначают e-. С 1932 г. в атомной физике пошло одно за другим открытие новых частиц, начиная с нейтрона, примерно равного по массе ядру водорода (названному протоном — «простейшим»), но лишенного электрического заряда. «Простейший» оказался, однако, не так-то прост, и механически построить из него ядра других атомов оказалось невозможно даже в теории. Действительно, если бы ядро атома с массой А состояло попросту из А протонов, то его заряд Ζ равнялся бы А, тогда как на деле А всегда больше, чем Ζ (кроме как для самого водорода). Обычно А примерно вдвое превосходит Ζ. На самом деле оказалось, как это показали советский физик Д.Д. Иваненко и немецкий физик В. Гайзенберг, что ядро атома состоит из Ζ протонов и А — Ζ нейтронов, тогда его заряд равен Ζ единиц, а относительная атомная масса равна Ζ+(Α — Ζ)=Α. Черное противоположно белому, светлое — темному, и в пару к отрицательному по заряду электрону была открыта такая же по массе частичка с таким же по величине, но положительным зарядом. Ее назвали позитроном. Позитрон скрывался до сих пор от нашего взора пользуясь тем, что его жизнь недолговечна. В земных условиях уже через миллионную долю секунды он встречается с электроном, и... они оба превращаются в два фотона. При химических реакциях атомы вступают в связь, оставаясь внутри молекулы неизмененными. При атомных или ядерных реакциях ядра атомов перестраиваются сами и дают новый атом с совершенно новыми химическими свойствами.
Химические реакции выражают формулами вида 2С + О2 — →2СО. Это означает, что два независимых друг от друга атома углерода, соединившись с молекулой кислорода, состоящей из двух его атомов, дают в результате две молекулы окиси углерода, обозначаемой CO. Сходные обозначения применяются для описания ядерных реакций. Алхимики прежних времен долго искали «философский камень» — способ превращать в золото малоценные металлы. Их труды были тщетны, их мечты не сбылись, атомы не желали в их руках превращаться друг в друга, но в XX веке наука обнаружила, что с некоторыми атомами эти «чудеса» происходят сами по себе, только золота при этом не получается. Так, например, атомы радиоактивных элементов урана и тория испытывают длинный ряд превращений в другие атомы. Эти необыкновенные превращения атомов урана и тория сопровождаются выбрасыванием из их недр ядер более легкого вещества — гелия и возникновением электронов и очень коротковолновых «жестких» (с малой длиной волны) электромагнитных лучей, называемых γ-лучами. В конце концов уран и торий превращаются в свинец. Ядра атомов гелия, или α-частицы (летящие со скоростью около 20000 км/с), оказались теми снарядами, которыми ученые смогли разрушить ядра некоторых других атомов и вскрыть для нас их природу. Налетая с большой скоростью на них, α-частицы разбивали эти ядра и образовывали из осколков новые химические элементы. Для этого надо было эти α-частицы добыть и направить в нужное место. Так английский физик Резерфорд в 1919 г. осуществил мечту алхимиков об искусственном превращении элементов. Столкнув ядро гелия 42He с ядром азота 147N, ему удалось превратить их в два других ядра: водорода и кислорода, правда, в форме редкого изотопа с атомной массой 17. Но ведь от этого, как мы уже знаем, кислород не перестает быть кислородом! Это чудесное превращение можно записать формулой 147N + 42H →178O + 11H. Обратите внимание, что суммы значков как верхних, так и нижних в правой и левой частях этого уравнения равны. Альфа-частицы поставляются радиоактивными атомами, но еще более «бронебойные», лучше сказать, «ядернобойные» снаряды получаются от искусственно получаемых и разгоняемых протонов и ядер тяжелого водорода (дейтронов). Для этой цели служат мощные ускорительные установки: циклотроны, линейные ускорители, синхроциклотроны, бетатроны, синхрофазотроны. С их помощью протоны, дейтроны и электроны разгоняются до огромных энергий, сравнимых с энергией космических лучей. Нейтроны, не имеющие заряда и не отталкиваемые ядрами, еще лучше проникают в их недра и действуют еще разрушительнее. Пригодны для этой цели и «жесткие» γ-лучи. За последние годы было искусственно произведено множество ядерных реакций. Из них особый интерес представили те, которые привели к новым радиоактивным ядрам. Новые ядра оказались крайне неустойчивыми, распадающимися уже самопроизвольно (т. е. без всякого внешнего воздействия, под влиянием внутренних причин) и очень быстро, отчего они и не встречались в природе. В конце концов у каждого элемента был найден один или несколько радиоактивных изотопов. Однако большинство этих «искусственных» радиоактивных ядер излучает не α-частицы, а выбрасывает только электроны либо позитроны. При искусственном преобразовании элементов, связанном с разрушением ядер, разрушающая частица необходимо должна иметь большую энергию, она должна нестись быстро, и этот разгон ей придается в лаборатории искусственно созданным электрическим полем. В природе же необходимую для разрушения ядер скорость разрушающим частицам дает высокая температура. Повышение температуры газа, как известно из физики, приводит к более оживленным движениям составляющих его молекул или атомов. Их скорости можно вычислить, зная температуру газа, а отсюда, зная массу атомов, легко определить энергию их движения, которая потом идет на работу разрушения ядер. Конструкторы бронебойного оружия, зная массу пули, рассчитывают ту скорость, которую ей надо сообщить, чтобы она могла пробить броню заданной толщины. Подобно этому, мы можем рассчитать температуру, при которой энергия движения разрушающих частиц достаточна для проникновения их в недра атомных ядер. Например два протона, несущихся навстречу друг другу, могут преодолеть взаимное отталкивание (усиливающееся при сближении) лишь при скорости, обусловленной температурой в 55 млн. градусов. Где же могут быть такие температуры?! Их нет не только в лаборатории, но и на поверхности звезд. Лишь в их недрах можем мы ожидать найти такие температуры, и к этому нас приводили любые теории внутреннего строения звезд еще задолго до того, как мы стали разбираться в ядерных реакциях. Там, в этих таинственных и невидимых недрах, масса вышележащих слоев звездной материи создает чудовищное давление и высокую плотность газа. В адской тесноте бешено носящиеся частички сталкиваются друг с другом и «обламывают друг другу бока» в том смысле, что уж внешние-то части атомов, т. е. их электронные оболочки, непрерывно от них отрываются. При этих температурах и давлениях ядра всех легких атомов должны обнажиться, так что в образовавшейся туче обломков оторванных, свободных электронов еще больше, чем ядер. Кому-нибудь из них удастся подхватить пролетающий мимо электрон, но ненадолго. Следующее же столкновение возвращает атомное ядро к его одиночеству. В земных и лабораторных условиях оболочки из внешних электронов, как щит, отчасти защищают ядра от роковых столкновений, в недрах же звезд только взаимное отталкивание служит этому помехой. Лучше всего защищены от ударов ядра тяжелых элементов, у которых большой заряд ядра и поэтому большая отталкивательная сила. Интересно отметить следующее свойство этого как бы «искрошенного» вещества, составляющего самые недра звезд. При вычислении величин, характеризующих разные физические условия и события в недрах звезд, играет важную роль средняя атомная масса частиц, их образующих. Казалось бы, она должна сильно зависеть от пропорции разных химических элементов, потому что относительная атомная масса водорода 1, а урана 238. Это как будто напоминает задачу о среднем весе неизвестных фруктов в закрытой корзине, где могут быть и вишни, и яблоки, и арбузы. Однако при полной ионизации атомов в недрах звезд каждый из них раскалывается на Ζ + 1 частицу (1 ядро и Ζ электронов), если атомный номер атома равен Ζ. Тогда относительная атомная масса смеси атомных обломков получается не А, а А : (Ζ +1) и, например, для чистого водорода составляет ½, а для чистого урана 2,6. Таким образом, незнание точного химического состава звездных недр мало влияет на оценку величины средней атомной массы частиц. Тяжелых атомов там не может быть очень много, и главную роль играет то или иное содержание водорода. Ряд данных заставляет считать, что Солнце по крайней мере на 50% состоит из водорода (по массе) и, следовательно, ввиду легковесности водородных атомов они составляют там подавляющее большинство, так что средняя атомная масса в звездных недрах должна быть близка к 1. Для того чтобы рассчитать скорость и действенность ядерных реакций в таком газе, надо знать структуру атомов, законы, действующие в их недрах, и притом все в численном виде, пригодном для математических расчетов, иначе мы будем иметь дело не с научной теорией, а с простыми предположениями. Прежде всего нужно ответить на вопрос, что произойдет с частицей, влетевшей в ядро. Оказывается, иногда частица может попросту пролететь сквозь ядро. Далее, ядро может удержать проникшую в него частицу, отдав принесенную ею энергию путем излучения γ-лучей. Наконец, ядро, в которое проникла частица, может распасться, как в одной из реакций, описанных выше. При разнообразии структуры ядер как своего рода крепостей можно ожидать большого разнообразия в типах столкновений и их последствий; опыты подтверждают эти ожидания и указывают, что для каждого данного типа ядер некоторые скорости столкновения для достижения желаемого результата благоприятнее, чем другие. Например, реакции, при которых сложное ядро, образовавшееся из двух столкнувшихся ядер, разломится на две (далеко не равные) части, гораздо вероятнее, чем реакции, при которых из сложного ядра выбросится только электрон или γ-луч. Вычисления вероятности и скорости протекания различных ядерных реакций при разных температурах начались с 1929 г. Нас интересуют, конечно, те реакции, которые сопровождаются выделением энергии. В ядрах атомов происходит удивительные превращения, которые показались бы нам невероятными, если бы мы не убедились в них непосредственно. Выделяющиеся при этих превращениях энергии даже трудно себе представить, так они огромны. Оказалось, что общая энергия какого-либо тела связана с его массой, причем эта связь выражается формулой E = mс2, где E — энергия, m — масса и c — скорость света. Для того чтобы охарактеризовать величину выделяющейся энергии, достаточно сказать, что сжигание тонны угля в чистом кислороде освобождает только 5·1016 эргов энергии, тогда как, выделив всю энергию, заключенную в одной тонне (безразлично угля, соломы или чего-либо иного), мы получили бы в 18 миллиардов раз больше. Если выделить всю энергию, связанную с кусочком угля, величиной с горошину, то ее хватило бы для огромного океанского парохода, чтобы объехать кругом земной шар. Однако освободить всю энергию, связанную с какой-либо массой, мы пока не можем. В частности, убыль массы, связанная с превращением вещества в излучение при радиоактивном распаде, измеряется небольшими долями процента. При радиоактивном распаде и при ядерных реакциях выделяется энергия, что связано с уменьшением массы участвующих в реакциях элементарных частиц. Совокупный результат таких событий, происходящих с мириадами атомов, дает ощутимый результат. Например, мы уверенно измеряем тепло, выделяемое в лаборатории радиоактивным веществом в объеме наперстка. Наконец, выделение тепла и вообще энергии при ядерных реакциях в недрах Солнца ощущается человечеством с первых дней его существования. Тепло Солнца сделало возможным возникновение и развитие жизни на Земле, и в известном смысле мы можем сказать, что мы с вами обязаны своим существованием тому, что в недрах далекого от нас Солнца идет непрерывное выделение энергии вместе с ничтожным уменьшением массы ничтожных атомов. Чтобы техника будущего могла воспользоваться чудовищными запасами энергии, скрытыми в атомах, чтобы вместо многих вагонов угля на океанские пароходы брать с собой в кругосветные плавания пробирку с каким-либо веществом, энергия которого должна быть использована в пути, надо будет пройти долгий путь. Еще не все тайны атомных ядер раскрыты, и раскрытию их помогает изучение небесных светил, бесконечно от нас далеких и, казалось бы, таких для нас бесполезных. К сожалению, многие люди не подозревают о том, что астрономия, считаемая ими занятием, далеким от жизни и праздным, является необходимейшим звеном в развитии и духовной и материальной культуры. В звездах и в Солнце главным источником энергии являются ядерные реакции. При уменьшении массы частиц, участвующих в этих реакциях, уменьшается и связанная с ними энергия, а освободившаяся энергия излучается в мировое пространство. Следовательно, при излучении масса Солнца уменьшается. Исходя из известной интенсивности излучения энергии Солнцем, мы приходим к заключению, что его масса ежесекундно убывает примерно на 4 миллиона тонн, которые уносятся излучением. Чудовищное число! — но обнаружить подобное уменьшение непосредственно невозможно, так как оно ничтожно мало в сравнении с массой всего Солнца. За то время, что существует земная кора (3 миллиарда лет), Солнце потеряло только 1/7500 часть своей массы. Если бы кто-либо мог с современной точностью определить массу Солнца на заре жизненного пути нашей планеты, то, сравнив ее с теперешними определениями, мы бы все равно не установили ее уменьшения. Точность определения массы небесных тел не достигает 0,01%, т. е. той величины, которой выражается относительное уменьшение массы Солнца за этот чудовищно долгий период времени. При ядерных реакциях в лабораториях выделение энергии сопровождается уменьшением массы не на тонны, а на ничтожнейшие доли миллиграмма, но это составляет уже заметную долю массы самих атомов, тоже ничтожно малой. Умудрившись точно измерять массу атома, физики сумели определить и ее изменение в результате ядерных реакций. Подобного рода изменения проявляются в том, что массы атомных ядер разных химических элементов относятся друг к другу не в точности как целые числа. Если относительную атомную массу кислорода 16O принять ровно за 16, как это всегда делается, то оказывается, например, что относительная атомная масса водорода составляет не ровно 1, а 1,00812, относительная атомная масса гелия 4He не ровно 4, а 4,00390, дейтерия не ровно 2, а 2,01470. На последнем примере — простейшем — рассмотрим это подробнее. Два водородных ядра или протона 11Н с массой 1,00812 — 0,00054 = 1,00758, соединяясь, образуют пару, состоящую из дейтрона 21H и позитрона. (У каждого протона один положительный заряд и, соединяясь, они дали бы двойной заряд, у дейтрона же только один положительный заряд, как и у протона, отчего носитель лишнего положительного заряда — позитрон — выделяется при образовании ядра.) Эту ядерную реакцию можно изобразить формулой 11H + 11H→21Н + e+. Выделенный при реакции позитрон, недолговечность которого уже отмечалась, быстро сливается с каким-либо свободным электроном. Слившись, они исчезают оба, превратившись в два кванта γ-излучения. Таким образом, соединение двух протонов и чуждого им до этих пор отрицательного электрона приводит к рождению дейтрона и γ-излучения. Масса образованного дейтрона вместе с позитроном составляет 2,01470 и на 0,00046 меньше массы двух протонов. За счет этой-то части, составляющей 0,00046:2,015 или 0,00022 (почти 0,02%) от исходной массы двух протонов, и возникли γ-кванты. При превращении грамма протонов в дейтроны выделится 6,8·1017 эргов. Это примерно в тысячу раз меньше энергии, заключенной в одном грамме протонов, но все же в пять раз больше, чем энергия, отданная одним граммом солнечного вещества за всю его жизнь, т. е. за несколько миллиардов лет. Мы видим, что по порядку величины лишь ядерные реакции (реально существующие и наблюдаемые нами в лаборатории) могут (и вполне удовлетворительно) играть роль машины, накачивающей энергию к солнечной поверхности. Примечания1. В настоящее время искусственно получены новые элементы, имеющие большую относительную атомную массу, чем уран. Их назвали: нептуний (Np, Z= 93), плутоний (Pu, Z= 94), америций (Am, Ζ=95), кюрий (Cm, Z= 96), берклий (Bk, 97), калифорний (Cf, Z=98), эйнштейний (Es, Z= 99), фермий (Fm, Ζ=100), менделевий (Md, Ζ=101), нобелий (No, Z=102), лоуренсий (Lr, Z=103) и курчатовий (Ku, Z= 104). Кроме того, искусственным путем получены элементы: технеций (Тс, Z=43), прометий (Pm, Z=61), астат (At, Z= 85) и франций (Fr, Z=87), не имеющие стабильных (т. е. не распадающихся) изотопов. Элементы 105—107 еще не получили официального наименования, а названия элементов 102, 103 и 104 не приняты окончательно.
|
© 2002—2025 Юрий Гирин подборка материалов
«Кабинетъ» — История астрономии. Все права на тексты книг принадлежат их авторам!
При копировании материалов проекта обязательно ставить ссылку